来源:鄂尔多斯高新区 | 2021-12-08 13:46:14 |
ACT001是由天津尚德药缘科技有限公司CEO、南开大学化学院教授陈悦及其团队历时12年研发成功的,已获得美国药监局FDA批准的儿童罕见病资格(简称RPDD)。在我国原创候选新药中,ACT001是首个获得美国RPDD资格的品种,这也是ACT001继2017年获得针对胶质母细胞瘤(GBM)的美国孤儿药资格,2018年获得GBM的欧盟孤儿药资格之后的又一重大突破。
此次ACT001获批的RPDD主要针对一种儿童罕见疾病:带H3K27突变的弥漫性中线胶质瘤(DMG),以前往往称为更小范围的弥漫性内生型脑桥胶质瘤(简称DIPG)。陈悦介绍:“这种疾病是脑胶质瘤的一种,好发于5—10岁的儿童,因为无法手术切除处于脑干部位的肿瘤,因此临床预后极差,中位生存期仅9—12个月,2年生存率在10%—25%,长期生存率不足1%。”而目前DIPG的治疗没有获批的药物,连目前胶质瘤治疗的最佳药物替莫唑胺,也未取得明显疗效。
AT001是一种多靶点小分子免疫调节剂,能够很好地穿过血脑屏障,并且能够可逆地开放血脑屏障,帮助其它药物提高入脑浓度,因此ACT001可用于颅内疾病的治疗。目前ACT001在全球已开展6项二期临床与2项儿童一期临床试验。其中,ACT001获得RPDD,主要支持数据来自于澳洲医生David Ziegler课题组治疗DIPG的临床试验结果,该结果以报告形式公布于2021年6月11日的美国神经肿瘤学会(SNO)儿童脑瘤会议。
陈悦教授团队为中国DIPG患者申请临床试验方案进行了调整,将剂量升高3倍,直至530-700mg/m2 BID以上的剂量,并采用在澳洲成功试用的新配方胶囊。相比老配方胶囊,该新配方胶囊含有等量的活性药物,但是体积小了大约3倍,且内容物完全水溶,方便患者服用。由于ACT001在一定剂量范围内对正常细胞有抗氧化与抗炎的保护作用,在超高剂量下仍然有很好的安全性。一位DIPG患儿服用700mg/m2 BID(相当于成人每天3克)的剂量超过1年,未出现药物相关的严重副作用。目前ATC001正在积极申报以上市为目标的欧美澳关键性二期临床试验。
(摄影:哈那嘎日)

2022-01-12 16:37:56

2022-01-12 16:35:51

2022-01-12 16:33:46

2022-01-12 16:31:37

2022-01-12 16:23:37
2022-01-10 23:50:47
2022-01-10 23:50:44
2022-01-10 23:50:28
2022-01-10 23:49:46
2022-01-10 23:49:40
2022-01-10 23:49:36

2022-01-10 16:58:03

2022-01-10 16:55:04

2022-01-10 16:52:42

2022-01-10 16:50:33

2022-01-10 16:47:29

2022-01-10 16:36:07
2022-01-10 16:34:44
2022-01-10 16:34:37
2022-01-10 16:34:32
2022-01-10 16:34:26
2022-01-10 16:34:23

2022-01-10 16:12:37

2022-01-10 15:29:11

2022-01-10 15:17:57

2022-01-10 15:13:38

2022-01-10 15:09:07

2022-01-10 15:06:46

2022-01-10 15:00:54

2022-01-10 14:58:48

2022-01-10 14:44:41

2022-01-10 14:37:13

2022-01-10 12:04:30

2022-01-10 11:05:30

2022-01-10 11:03:01

2022-01-10 11:01:18

2022-01-10 10:46:24

2022-01-10 10:26:59

2022-01-10 10:22:55

2022-01-10 10:16:57

2022-01-10 10:08:05
2022-01-10 10:03:29

2022-01-10 10:02:08

2022-01-10 09:32:02

2022-01-10 08:59:32

2022-01-10 08:43:11

2022-01-10 08:32:05

2022-01-10 08:24:26

2022-01-10 08:17:51

2022-01-10 08:14:12

2022-01-09 17:10:02

2022-01-09 11:42:38

2022-01-08 14:14:03

2022-01-08 14:02:46
2022-01-07 22:27:18
2022-01-07 22:26:23
2022-01-07 22:25:41

2022-01-07 17:24:23

2022-01-07 16:39:41

2022-01-07 16:36:27

2022-01-07 16:30:57

2022-01-07 16:18:03

2022-01-07 16:08:57
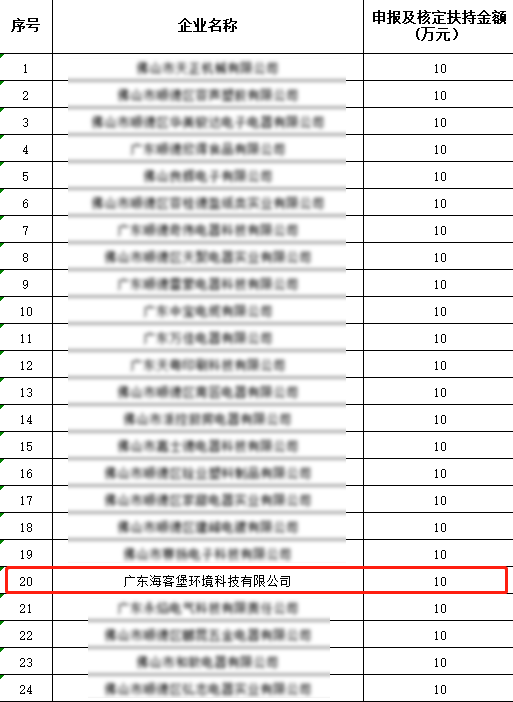
2022-01-07 15:58:32

2022-01-07 15:58:20

2022-01-07 15:49:44

2022-01-07 15:31:33

2022-01-07 15:19:10

2022-01-07 15:09:59
2022-01-07 15:04:22
2022-01-07 15:04:18
2022-01-07 15:04:14
2022-01-07 15:04:10
2022-01-07 15:04:06
2022-01-07 15:04:02

2022-01-07 11:59:10

2022-01-07 10:56:03

2022-01-07 10:50:14

2022-01-07 10:41:11

2022-01-07 10:34:51

2022-01-07 10:27:42

2022-01-07 10:19:35

2022-01-07 10:15:46

2022-01-07 10:08:05

2022-01-07 10:04:02

2022-01-07 09:59:42

2022-01-07 09:46:39

2022-01-07 09:20:56

2022-01-07 09:15:25

2022-01-07 09:09:44

2022-01-07 08:43:15
2022-01-06 23:07:55
2022-01-06 23:07:48
2022-01-06 23:07:44
2022-01-06 23:07:22
2022-01-06 23:07:18

2022-01-06 17:07:00

2022-01-06 17:00:29

2022-01-06 16:55:06

2022-01-06 16:49:08

2022-01-06 16:46:42

2022-01-06 16:39:47

2022-01-06 16:35:47

2022-01-06 16:27:44

2022-01-06 16:05:49
